П-76 Гомболевский В.А., Лайпан А.Ш., Шапиев А.Н., Владзимирский А.В., Морозов С.П. Применение критериев ответа солидных опухолей на химиотерапевтическое лечение (RECIST 1.1) / Серия «лучшие практики лучевой и инструментальной диагностики». – Вып. 8. – М., 2018. – 15 с.

УДК 615.84+616-073.75
ББК 53.6
П-76
Организация-разработчик:
Государственное бюджетное учреждение здравоохранения города Москвы «Научно-практический центр медицинской радиологии Департамента здравоохранения города Москвы»
Составители:
Гомболевский В.А. – к.м.н., руководитель отдела развития качества радиологии ГБУЗ «НПЦМР ДЗМ»
Лайпан А.Ш. – врач-рентгенолог, аналитик отдела координации научной деятельности ГБУЗ «НПЦМР ДЗМ»
Шапиев А.Н. – аналитик отдела координации научной деятельности ГБУЗ «НПЦМР ДЗМ»
Владзимирский А.В. – д.м.н., заместитель директора по научной работе ГБУЗ «НПЦМР ДЗМ»
Морозов С.П. – д.м.н., профессор, главный внештатный специалист МЗ РФ по лучевой и инструментальной диагностике по ЦФО РФ, главный внештатный специалист по лучевой диагностике ДЗМ, директор ГБУЗ «НПЦМР ДЗМ»
П-76 Гомболевский В.А., Лайпан А.Ш., Шапиев А.Н., Владзимирский А.В., Морозов С.П. Применение дополнительных к RECIST 1.1 критериев ответа опухолей на химиотерапевтическую таргетную терапию / Серия «Лучшие практики лучевой и инструментальной диагностики». – Вып.9. – М., 2018. – 15 с.
Рецензенты:
Владимир Николаевич Троян – д.м.н., профессор, начальник центра лучевой диагностики ФГКУ "ГВКГ им. акад. Н.Н. Бурденко" Министерства обороны Российской Федерации
Дмитрий Владимирович Буренчев – д.м.н., заведующий отделением рентгенодиагностических и радиоизотопных методов исследований ГБУЗ "Городская клиническая больница им. А.К. Ерамишанцева ДЗМ"
Предназначение: методические рекомендации предназначены для использования в повседневной практике врачами-рентгенологами для оценки ответа опухолей на химиотерапевтическую таргетную терапию.
Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения
© Департамент здравоохранения города Москвы, 2018
© ГБУЗ г. Москвы «Научно-практический центр медицинской радиологии Департамента здравоохранения города Москвы», 2018
© Коллектив авторов, 2018
ISSN 2618-7124
СОДЕРЖАНИЕ
- Обозначения и сокращения
- Введение
- Основная часть
- Требования к параметрам сбора данных
- Понятие измеряемых образований
- Понятие неизмеряемых образований
- Особые типы объемных образований
- Целевые очаги
- Оценка динамики очагов в каждой временной точке
- Правила оценки целевых образований
- Оценка целевых образований
- Оценка нецелевых образований
- Критерии оценки новых опухолевых очагов
- Суммарная таблица оценки заболевания по RECIST 1.1.
- Заключение.
- Список использованных источников.
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
ВИ – взвешенное изображение
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
ПЭТ/КТ – позитронно-эмиссионная томография, совмещенная с КТ
УЗИ – ультразвуковое исследование
ФДГ – фтордезоксиглюкоза
RECIST – response evaluation criteria in solid tumors (критерии ответа солидных опухолей на лечение)
mRECIST – modified response evaluation criteria in solid tumors (модифицированные критерии ответа солидных опухолей на лечение)
mts – метастазы
RANO – response assessment in neuro-oncology (оценка ответа в нейроонкологии)
ВВЕДЕНИЕ
Данные рекомендации предназначены для врачей-рентгенологов, в повседневной практике сталкивающихся с проблемой оценки динамики опухолевых очагов на фоне проводимого лечения.
Критерии оценки ответа опухолей на лечение (response evaluation criteria in solid tumors – RECIST) разработаны Европейской организацией по исследованию и лечению рака (European Organisation for Research and Treatment of Cancer – EORTC), Национальным институтом злокачественных новообразований США (National Cancer Institute – NCI), а также Национальным онкологическим институтом Канады (National Cancer Institute of Canada) и впервые внедрены в практику в 2000 году. В настоящее время актуальной является вторая редакция – RECIST 1.1, выпущенная в 2009 году.
Критерии RECIST 1.1 предназначены исключительно для оценки солидных новообразований и не применяются для оценки эффективности лечения при следующих заболеваниях:
- Лимфомы (альтернатива – критерии Cheson);
- Опухоли головного мозга (альтернатива – критерии RANO);
- Гепатоцеллюлярный рак (альтернатива – критерии mRECIST);
- Гастроинтестинальные стромальные опухоли (альтернатива - критерии Choi).
Ключевые этапы оценки динамики заболевания по RECIST
- Оценка первичного исследования, которая включает в себя:
- Поиск измеряемых очагов;
- Выбор целевых и нецелевых образований;
- Измерение целевых образований;
- Определение суммарной опухолевой массы.
- Оценка контрольного исследования, которая включает в себя:
- Измерение целевых образований;
- Оценка нецелевых образований и поиск новых очагов;
Расчет ответа опухоли в зависимости от временной точки.
ОСНОВНАЯ ЧАСТЬ
Требования к параметрам сбора данных
- Для компьютерной томографии (КТ):
- Толщина среза ≤ 5 мм;
- Использование внутривенного контрастного усиления (трехфазное для оценки очагов в печени);
- Поле обзора должно включать кожу.
- Для магнитно-резонансной томографии (МРТ):
- Рекомендуется выполнение аксиальных Т1ВИ и Т2ВИ, аксиальных Т1ВИ после введения контрастного препарата;
- Толщина среза ≤ 5 мм;
- Выполнение контрольных исследований на одинаковых аппаратах.
- Для позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ/КТ):
- КТ-часть ПЭТ/КТ обычно имеет низкое качество и не должна использоваться для оценки динамики очагов по сравнению с КТ диагностического качества;
- В случае если КТ-часть имеет высокое качество, выполнена с внутривенным контрастным усилением, допустимо сравнение с осторожностью.
- Использование рентгенографии грудной клетки, УЗИ не рекомендуется по причине слабой воспроизводимости методов.
Понятие измеряемых образований
- Объемное образование ≥ 10 мм наибольшим диаметром на аксиальной реконструкции КТ или МРТ с толщиной среза ≤ 5 мм.
- Лимфатические узлы ≥ 15 мм по короткой оси на КТ или МРТ
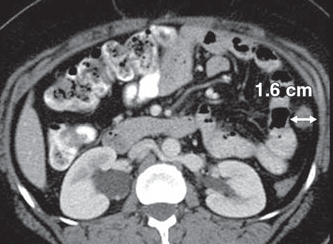
Рисунок 1 - Очаг по брюшине 1.6 см
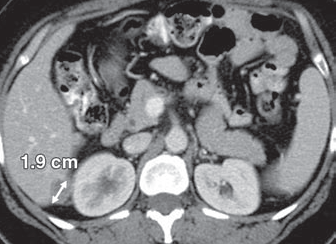
Рисунок 2 - Mts очаг в печени 1,9 см
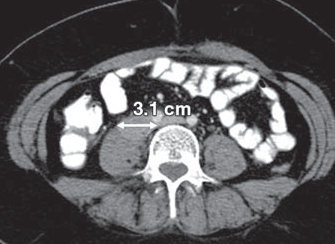
Рисунок 3 - Подвздошный лимфоузел 3,1 см
Понятие неизмеряемых образований
К неизмерямым следует относить все прочие проявления онкологического процесса, размеры которых невозможно точно измерить:
- Очаги <10 мм;
- Лимфатические узлы 10-14 мм по короткой оси;
- Лептоменингеальные метастазы;
- Асцит, плевральный и перикардиальный выпот;
- Лимфогенный канцероматоз;
- Органомегалия.
Особые типы объемных образований
Костные очаги
Остеосцинтиграфия, как и ПЭТ/КТ, могут быть использованы для оценки появления/исчезновения очагов, но не для оценки их размеров; измеряемым является только мягкотканный компонент остеолитического очага; остеобластические очаги являются неизмеряемыми образованиями (рисунок 4).
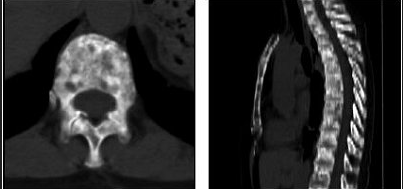
Рисунок 4 - Костные очаги
Кистозные очаги
Использование кистозных очагов в качестве измеряемых объемных образований не рекомендуется.
Целевые очаги
Из общего количества измеряемых очагов отбираются целевые очаги, по которым в дальнейшем количественно оценивается динамика заболевания. Прочие (нецелевые очаги) оцениваются качественно.
Критерии отбора целевых очагов
- Не более 5 очагов в организме, не более 2 в одном органе (парные органы считаются одним органом);
- Рекомендуется измерение наибольших очагов, оценка размеров которых наиболее воспроизводима;
- Учитывается наибольший диаметр опухолевого очага (аксиальная реконструкция);
- Учитывается размер лимфатического узла по короткой оси;
- Продуктом всех измерений является «сумма наибольших размеров»;
- Не следует относить к целевым очагам опухолевые образования, которые подвергались лучевому лечению;
- Следует включать в измерение кольцо периферического контрастного усиления (рисунок 5).
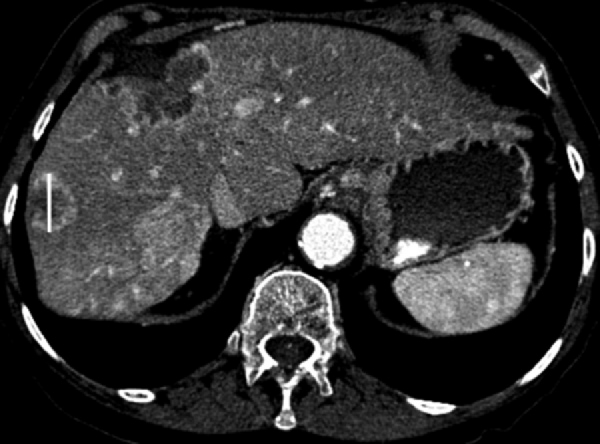
Рисунок 5 - Целевой очаг
Оценка динамики очагов в каждой временной точке
- Требуется измерять выбранные ранее целевые образования (даже если они не являются наибольшими при контрольном исследовании);
- Рекомендуется оценивать все ранее выявленные нецелевые образования;
- Поиск новых явных опухолевых образований.
Правила оценки целевых образований
- Измерения наибольшего размера производятся для каждого целевого образования;
- Лимфатические узлы измеряются по короткой оси;
- Все измерения суммарно складываются в сумму наибольших размеров;
- Если очаг слишком мал для измерения, его размер принимается за 5 мм;
- Если очаг исчез полностью, его размер считается равным 0.
Слияние или разделение очагов
- Если целевой очаг разделяется на более мелкие, измеряется сумма наибольших размеров всех мелких очагов.
- Если целевые очаги сливаются в один, измеряется наибольший размер сливного очага.
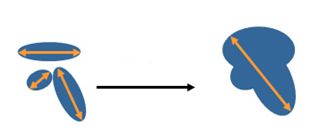
Рисунок 6 - Слияние очагов
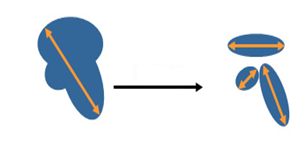
Рисунок 7 - Разделение очагов
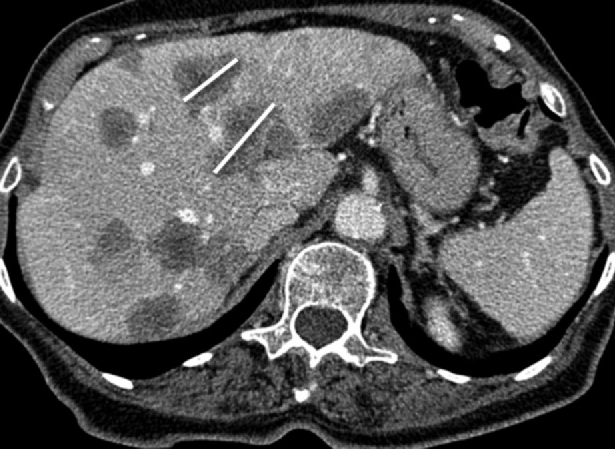
Рисунок 8 - Сливной очаг
Оценка целевых образований
Таблица 1 - Оценка целевых образований по RECIST 1.1
| Тип ответа | Определение |
| Полный ответ | Исчезновение всех экстранодальных целевых образований. Все патологические лимфатические узлы должны уменьшиться < 10 мм по короткой оси в абсолютном значении. |
| Частичный ответ | Уменьшение суммы наибольших размеров очагов более чем на 30 %; для сравнения берется первичное исследование |
| Прогрессирование заболевания |
|
| Стабильный процесс | Все прочие случаи |
Выбор базового исследования
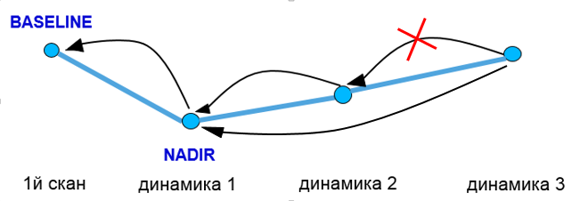
- При неизмененном тренде сравнение производить с исходной точкой (baseline);
- При изменении тренда производить сравнение с точкой наименьших измерений (nadir)
Оценка нецелевых образований
Таблица 2 - Оценка нецелевых образований
| Тип ответа | Определение |
| Полный ответ |
|
| Прогрессирование заболевания | Бесспорное прогрессирование нецелевых очагов |
Критерии оценки новых опухолевых очагов
- Находка нового опухолевого очага должна быть бесспорной; очаг ни при каких условиях не может иметь иной генез;
- Очаг может не соответствовать критериям «измеряемого»;
- Если появление нового очага является сомнительным, следует продолжить его контроль до следующей временной точки. При подтверждении данных о новом опухолевом очаге датой прогрессирования заболевания считается первое исследование, выявившее новый очаг;
- Опухолевые очаги, обнаруженные в анатомических локализациях, не вошедших в зону исследования при первом сканировании, считаются новыми.
Рекомендации по использованию ПЭТ/КТ с ФДГ при оценке новых очагов
- Очаг считается «ФДГ-позитивным» в случае, если гиперфиксация РФП в нем более чем в 2 (два) раза превышает окружающую ткань;
- Случай, когда очаг ФДГ-позитивен при настоящем исследовании и ФДГ-негативен при предыдущем, считается прогрессированием заболевания (равнозначно появлению нового опухолевого очага);
- Если ПЭТ/КТ с ФДГ выполнена для контроля заболевания впервые, то ФДГ-позитивные очаги при наличии соответствующих очагов на предыдущем КТ не соответствуют прогрессированию заболевания.
Возврат опухолевых образований
- Вновь появившийся целевой опухолевый очаг должен быть измерен и добавлен к сумме наибольших размеров;
- При выставлении «стабильного процесса» при предыдущей временной точке вновь появившийся целевой опухолевый очаг соответствует прогрессированию заболевания.
Суммарная таблица оценки заболевания по RECIST 1.1.
Таблица 3 - Суммарная оценка заболевания по RECIST 1.1
| Целевые очаги | Нецелевые очаги | Новые очаги | Общий ответ |
| Полный ответ | Полный ответ | Нет | Полный ответ |
| Полный ответ | Частичный ответ/стабильный процесс | Нет | Частичный ответ |
| Полный ответ | Нельзя оценить | Нет | Частичный ответ |
| Частичный ответ | Нет прогрессирования заболевания или нельзя оценить | Нет | Частичный ответ |
| Стабильное заболевание | Нет прогрессирования заболевания или нельзя оценить | Нет | Стабильное заболевание |
| Нельзя оценить | Нет прогрессирования заболевания | Нет | Нельзя оценить |
| Прогрессирование заболевания | Любое состояние | Любое состояние | Прогрессирование заболевания |
| Любое состояние | Прогрессирование заболевания | Любое состояние | Прогрессирование заболевания |
| Любое состояние | Любое состояние | Есть | Прогрессирование заболевания |
ЗАКЛЮЧЕНИЕ
Унификация критериев оценки эффективности проводимого лечения является самым актуальным вопросом в лучевой диагностике, ввиду того, что ведение онкологических больных, согласно современным стандартам, систематически сопровождается контролем проводимых лечебных мероприятий.
Критерии ответа солидных опухолей на химиотерапевтическое лечение RECIST 1.1 – один из наиболее широко распространённых способов оценки его эффективности.
Отличительной особенностью пособия является подробное изложение требований к методике проведения оценки эффективности лечения.
Данное методическое пособие представляет собой перевод оригинального издания и позволяет специалистам лучевой диагностики использовать рекомендуемые критерии в повседневной практике, что делает пособие «настольной книгой» врача-рентгенолога, неминуемо сталкивающегося с онкологической патологией в практической деятельности.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Bogaerts, J. Individual patient data analysis to assess modifications to the RECIST criteria / J. Bogaerts, R. Ford, D. Sargent, et al // Eur J Cancer. – 2009. – 45: 248–60.
- Eisenhauer, E.A. Response assessment in solid tumours (RECIST): version 1.1 and supporting Papers. / E.A. Eisenhauer, P. Therasse, J. Bogaerts // European Journal of Cancer. – 2009. – Volume 45, Issue 2: 225–31.
- Sargent, D. Validation of novel imaging methodologies for use as cancer clinical trials end-points / D. Sargent, L. Rubinstein, L. Schwartz, et al. // Eur J Cancer. – 2009. – 45: 290–9.
- Schwartz, L.H. Evaluation of lymph nodes with RECIST 1.1 / L.H. Schwartz, J. Bogaerts, R. Ford, et al. // Eur J Cancer. – 2009. – 45: 261–267.
- Shankar, L.K. National Cancer Institute. Consensus recommendations for the use of 18F-FDG PET as an indicator of therapeutic response in patients in National Cancer Institute Trials / L.K. Shankar, J.M. Hoffman, S. Bacharach, et al. // J Nucl Med. – 2009. – 47(6): 1059–66.
- Scher, H. Design and end points of clinical trials for patients with progressive prostate cancer and castrate levels of testosterone: recommendations of the Prostate Cancer Clinical Trials Working Group / H. Scher, S. Halabi, I. Tannock, et al. // J Clin Oncol. – 2009. – 26: 1148–59
- Vergote, I. Re: new guidelines to evaluate the response to treatment in solid tumors [ovarian cancer]. Gynecologic Cancer Intergroup / I. Vergote, G.J. Rustin, E.A. Eisenhauer, et al. // J Natl Cancer Inst. – 2000. – 92: 1534–5.


